- Início
- O que é coronavírus
- ES SOLIDÁRIO
-
Transparência
- Painel Covid-19
- Painel de Vacinação
- Painel Isolamento Social
- Painel Ocupação de Leitos
- PAINEL LEITOS DA REDE PRIVADA - ES
- População Privada de Liberdade
- Etnias Indígenas
- Estoque de seringas e agulhas
- Contratos e Execução de Despesas
- Despesas Enfretamento COVID-19
- Editais / Fases das Licitações
- Doações ES Solidário
- Panorama de TESTES DISPONÍVEIS
- Medidas Econômicas e Sociais
- Relatórios da Ouvidoria sobre COVID-19
- Fonte e Metodologia dos Dados
- Notícias
- Legislação
Vacinação contra a COVID-19
O Espírito Santo recebeu no dia 18 de janeiro as primeiras doses da vacina contra o novo Coronavírus (Covid-19), dando início à campanha de vacinação no Estado. Alguns municípios iniciaram a vacinação no dia 19 de janeiro, quando o Governo do Estado – por meio da Secretaria da Saúde (Sesa) – iniciou a distribuição das doses da Coronavac, do Instituto Butantan, para atender ao público-alvo definido pelo Plano Nacional de Operacionalização da vacinação contra a Covid-19 (PNO).
Atualmente, existem quatro vacinas contra covid-19 com autorização para uso no Brasil pela Anvisa: duas com autorização para uso emergencial (Sinovac/Butantan e Janssen) e duas com registro definitivo (AstraZeneca/Fiocruz e Pfizer/Wyeth). As vacinas das Farmacêuticas AstraZeneca e Sinovac estão em uso desde o início da Campanha Nacional de Vacinação contra a Covid-19 no país. Já as vacinas Pfizer/Wyeth e Janssen foram incorporadas ao longo da Campanha.
As definições contidas no Plano de Operacionalização da Vacinação contra a Covid-19 são dinâmicas, condicionadas às características e disponibilidade das vacinas aprovadas e adquiridas para o uso no país, e poderão ser ajustadas de acordo com a adequação dos grupos prioritários, população alvo, capacitações e estratégias para a vacinação.
Neste momento, o Estado do Espírito Santo está contemplando toda a população acima de 5 anos de idade com a primeira e segunda dose da vacina contra a covid-19 e implementando o reforço da vacinação para as pessoas acima de 18 anos de idade aptas a receber a dose.
CRONOGRAMA DE VACINAÇÃO VIGENTE
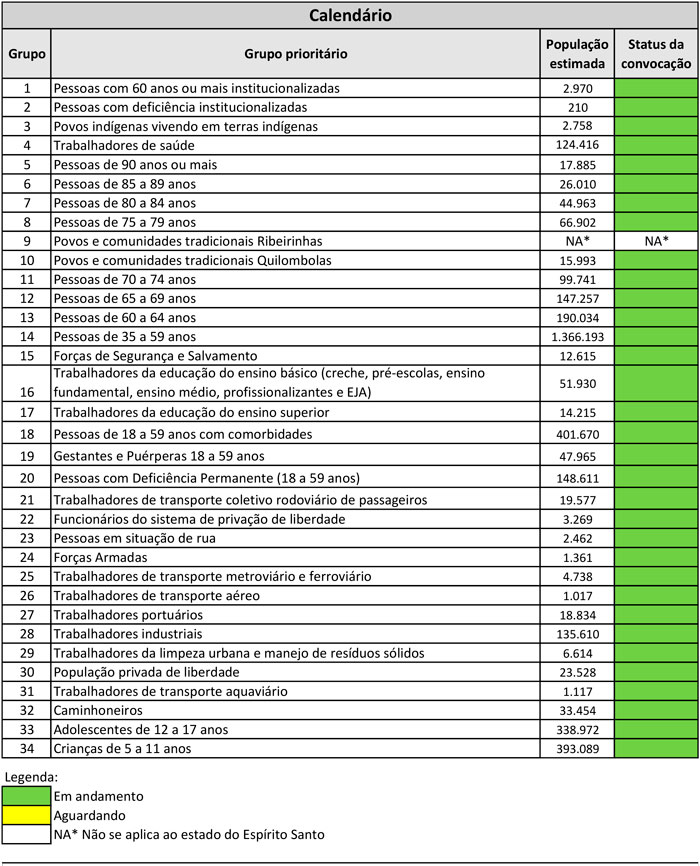
Data de atualização: 28/04/2022 (Periodicidade: Atualizado conforme o anúncio de novos grupos)
CLIQUE AQUI PARA ACESSAR TODA LEGISLAÇÃO RELACIONADA À VACINAÇÃO
COMO SE VACINAR
Nos postos de saúde, através do agendamento online ou telefônico, e outras estratégias de vacinação adotadas pelos municípios como por exemplo livre demanda e vacinação extramuros (escolas, shoppings, igrejas, praças, terminais de ônibus, dentre outros).
É importante que o cidadão busque a informação no seu município.
SOBRE A VACINA
Vacina CoronaVac COVID-19 (Sinovac/Butantan)
É uma vacina contendo antígeno do vírus inativado SARS-CoV-2. Cada dose de 0,5 mL contém 600 SU do antígeno do vírus inativado SARS-CoV-2 Aprovada em 19/01/2020 para uso emergencial no Brasil pela ANVISA. Os estudos de soroconversão da vacina adsorvida covid-19 (Inativada), demonstraram resultados superiores a 92% nos participantes que tomaram as duas doses da vacina no intervalo de 14 dias e mais do que 97% em participantes que tomaram as duas doses da vacina no intervalo de 28 dias. A eficácia desta vacina foi demonstrada em um esquema contendo 2 doses com intervalo de 2 a 4 semanas. Para prevenção de casos sintomáticos de covid19 que precisaram de assistência ambulatorial ou hospitalar a eficácia foi de 77,96%. Não ocorreram casos graves nos indivíduos vacinados, contra 7 casos graves no grupo placebo.
Vacina Covishield COVID-19 (AstraZeneca/Fiocruz)
A vacina covid-19 (recombinante) desenvolvida pelo laboratório AstraZeneca/Universidade de Oxford em parceria com a Fiocruz é uma vacina contendo dose de 0,5 mL. Cada dose de 0,5 mL contém 5 × 1010 partículas virais (pv) do vetor adenovírus recombinante de chimpanzé, deficiente para replicação (ChAdOx1), que expressa a glicoproteína SARS-CoV-2 Spike (S). Produzido em células renais embrionárias humanas (HEK) 293 geneticamente modificadas. Os estudos de soroconversão da vacina covid-19 (recombinante) demonstraram resultados em ≥ 98% dos indivíduos em 28 dias após a primeira dose e > 99% em 28 dias após a segunda dose. A eficácia desta vacina foi demonstrada em um esquema contendo 2 doses com intervalo de 12 semanas. Os indivíduos que tinham uma ou mais comorbidades tiveram uma eficácia da vacina de 73,43%, respectivamente, foi similar à eficácia da vacina observada na população geral. Conforme a bula, atualizada pela ANVISA em setembro de 2021, o esquema vacinal primário com a vacina covid-19 (recombinante) consiste de duas doses separadas de 0,5 mL cada. A segunda dose deve ser administrada entre 4 e 12 semanas após a primeira dose. Recomenda-se que indivíduos que receberam uma primeira dose da vacina covid-19 (recombinante) concluam o esquema de vacinação com a vacina covid-19 (recombinante), excepcionalmente gestantes, puérperas e casos de hipersensibilidades ou anafilaxias e indicação médica. Em reuniões realizadas no âmbito da Câmara Técnica Assessora em Imunização e Doenças Transmissíveis, o Programa Nacional de Imunizações optou por adotar o esquema de duas doses da vacina COVID-19 AstraZeneca com intervalo de 12 semanas. Entretanto, diante da atualização dos dados epidemiológicos que apontam para uma maior disseminação da variante delta em muitas cidades brasileiras e da disponibilidade de doses suficientes do imunizante, o PNO revisou as suas recomendações e passou a adotar o intervalo de 8 semanas entre a primeira e segunda dose da vacina AstraZeneca a partir do dia 05 de outubro de 2021.
Vacina covid-19 (RNAm) (Comirnaty) – Pfizer/Wyeth
A vacina COVID-19 (RNA mensageiro) desenvolvida pelo laboratório Pfizer/BioNTech é registrada no Brasil pela farmacêutica Wyeth. Cada dose de 0,3mL contém 30 µg de RNAm que codifica a proteína S (spike) do SARS-CoV-2. A vacina na apresentação de frasco multidose deve ser diluída com 1,8mL de solução de cloreto de sódio 0,9% (soro fisiológico 0,9%). Após a diluição, o frasco contém 2,25ml. A vacina é distribuída em frascos multidose, contendo 6 doses em cada frasco, sendo necessária a diluição do princípio ativo com 1,8mL de solução de cloreto de sódio 0,9% (soro fisiológico), de tal forma que cada dose utilizada será de 0,3mL. A vacina deve ser administrada por via intramuscular em esquema de duas doses. O intervalo descrito em bula é de três semanas ou mais entre as doses. A eficácia vacinal geral, em estudos de fase 3, que incluíram 43.548 participantes, avaliando-se covid-19 sintomática confirmada por RT-PCR com início após 7 dias da segunda dose, foi de 95,0% (90,0%–97,9%), tendo sido semelhante nas diferentes faixas etárias. Reanalisando dados desses estudos, a eficácia após duas semanas da primeira dose e antes da segunda dose foi de 92,6% (69,0%-98,3%). De acordo com a bula do imunizante atualizada para administração em população acima de 12 anos, em uma análise do Estudo 2 realizada em adolescentes de 12 a 15 anos de idade sem evidência de infecção anterior, não houve casos em 1.005 participantes que receberam a vacina e 16 casos de 978 que receberam placebo. A estimativa pontual de eficácia é de 100% (intervalo de confiança de 95% 75,3, 100,0). Nos participantes com ou sem evidência de infecção anterior, houve 0 casos em 1119 que receberam a vacina e 18 casos em 1110 participantes que receberam placebo. Isso também indica que a estimativa pontual para eficácia é de 100% (intervalo de confiança de 95% 78,1, 100,0). No Estudo 2, uma análise dos títulos neutralizantes de SARS-CoV-2 1 mês após a Dose 2 foi realizada em um subgrupo de participantes selecionados 26 aleatoriamente que não tinham evidências sorológicas ou virológicas de infecção anterior por SARS CoV-2 até 1 mês após a Dose 2, comparando a resposta entre adolescentes de 12 a 15 anos de idade (n = 190) com participantes de 16 a 25 anos de idade (n = 170). Estudos de vida real, demonstraram elevada efetividade vacinal, seja para trabalhadores de saúde da linha de frente (80% após a primeira dose e 90% após a segunda contra infecção pelo SARS-CoV-2), idosos acima de 70 anos (redução do risco de internação hospitalar de cerca de 80% e de risco de óbito pela covid-19 de 85%), ou na população geral (97% contra casos sintomáticos, necessidade de internação ou morte pela covid-19). Considerando dados de eficácia e de efetividade, demonstrando elevada proteção para formas graves da doença com a primeira dose bem como redução na transmissibilidade dos indivíduos vacinados com a primeira dose, os estudos de imunogenicidade demonstrando maior resposta de anticorpos com o uso do intervalo aumentado entre as doses (12 semanas versus 21 dias), as projeções de modelagem matemática indicando redução do número de casos, internações e óbitos com a ampliação do intervalo, visando aumentar a parcela da população vacinada com pelo menos 1 dose, respaldado ainda pelas discussões realizadas no âmbito da Câmara Técnica Assessora em Imunização e Doenças Transmissíveis (Portaria nº 28 de 03 de setembro de 2020), o Programa Nacional de Imunizações optou por, naquele momento, adotar o esquema de duas doses da vacina COVID-19 Pfizer/Wyeth com intervalo de12 semanas. Entretanto, diante da atualização dos dados epidemiológicos que apontam para uma maior disseminação da variante delta em muitas cidades brasileiras e da disponibilidade de doses suficientes do imunizante, o PNO revisou as suas recomendações e passou a adotar o intervalo de 8 semanas entre a primeira e segunda dose da vacina Pfizer. Ressalta-se que tal recomendação está em consonância com a estratégia adotada em outros países e se aproxima da recomendação original do fabricante. Ressalta-se que tal recomendação está em consonância com a estratégia adotada em outros países como os programas do Reino Unido e Canadá. De acordo com a bula do fabricante o esquema vacinal primário completo se dará com duas doses, com intervalo de 3 a 12 semanas com o mesmo imunizante, não havendo dados disponíveis sobre a intercambialidade de ComirnatyTM com outras vacinas contra COVID-19, assim para completar a série de vacinação. Os indivíduos que tenham recebido uma dose de ComirnatyTM devem receber uma segunda dose de ComirnatyTM para completar a série de vacinação.
Vacina covid-19 (recombinante) – Janssen
A vacina covid-19 (recombinante) da Farmacêutica Janssen, na composição por dose de 0,5mL contém Adenovírus tipo 26 que codifica a glicoproteína spike SARSCoV-2, produzido na linha celular PER.C6 TetR e por tecnologia de DNA recombinante, não inferior a 8,92 log10 unidades infecciosas (Inf.U), na apresentação de frasco-ampola multidose de 2,5mL (5 doses). Possui administração intramuscular e é utilizada em dose única de 0,5 mL (contendo 5 x1010 partículas virais), o que é uma vantagem em relação às demais vacinas disponíveis atualmente no Brasil. O estudo clínico de fase III incluiu aproximadamente 40.000 indivíduos sem evidência de infecção prévia pelo SARS-CoV-2, com idades entre 18-100 anos, e avaliou a eficácia vacinal em prevenir a covid-19 sintomática, moderada a grave/crítica e confirmada laboratorialmente. Dados preliminares indicam que a eficácia global foi de 66,3% (IC95% = 57,2%-72,4%) após ≥14 dias da vacinação com dose única, sendo que uma eficácia de ≥63% foi observada em diferentes categorias por idade, sexo, raça/etnia e entre aqueles com comorbidades. Ademais, houve variação da eficácia geograficamente, sendo de 64,7% (IC95% = 54,1%-73%) no Brasil - onde 69,4% dos participantes que fizeram sequenciamento genético apresentavam infecção pela linhagem P.2 -, de 52% (IC95% = 30,3 – 73,1%) na África do Sul (onde 94,5% dos casos sequenciados apresentavam a variante 20H/501Y.V2) e de 74,4% nos Estados Unidos (onde 96,4% dos sequenciados possuíam a variante D614G). Não houve identificação das linhagens B.1.1.7 ou P1 no estudo. Em relação à capacidade da vacina em evitar hospitalizações, a eficácia estimada foi de 93,1% (IC95% = 71,1%- 98,4%) ≥14 dias da vacinação; sendo que após ≥28 dias, não houve hospitalizações no grupo vacinado (eficácia estimada em 100%, IC95% = 74,3%-100%). A eficácia contra mortalidade global foi de 75% (IC95% 33,4%- 90,6%), não sendo detectada nenhuma morte associada a covid-19 no grupo vacinado (contra 7 no grupo placebo). Além disso, dados preliminares sugerem que possa haver proteção vacinal também contra infecções assintomáticas, pois 0,7% dos que receberam a vacina e que não apresentaram sintomas apresentaram soroconversão para uma proteína não-S versus 2,8% no grupo placebo (eficácia estimada de 74,2%; IC95% = 47,1%-88,6%). Quanto à segurança e à reatogenicidade vacinal no estudo de fase III, apesar de frequentes, a maioria dos eventos adversos foram leves a moderados e com resolução após 1–2 dias da vacinação, sendo mais frequentes entre 18-59 anos do que naqueles com idade ≥60 anos. Reações locais ou sistêmicas grau ≥3 foram mais comuns em vacinados do que naqueles que receberam placebo (2,2% contra 0,7%, respectivamente). A frequência de eventos adversos graves foi baixa (0,4%), tanto em vacinados quanto nos que receberam placebo; desses, 3 foram considerados relacionados à vacinação de acordo com o FDA (dor no local da aplicação, hipersensibilidade e reatogenicidade sistêmica).
Vacina covid-19 (RNAm) (Comirnaty), formulação infantil
Mediante aprovação da ANVISA, em 16 de dezembro de 2021, o Ministério da Saúde dá continuidade à campanha nacional de vacinação contra a covid-19 com a ampliação do seu portfólio. A partir de 14 de janeiro de 2021 a população infantil, entre 5 anos e 11anos e 11 meses, passa a ter disponível a vacina Pfizer Comirnaty na formulação infantil. A formulação desenvolvida pelo laboratório Pfizer/Biontech é registrada no Brasil sob o registro ANVISA n°1.2110.0481.004-3, direcionada a este público-alvo (crianças entre 5 anos e 11anos e 11 meses) possui dose pediátrica de 0,2ml contém 10 μg de RNAm. A vacina voltada à população pediátrica, disponível na apresentação de frasco multidose, 10 (dez) doses, deve ser diluída com 1,3ml de solução de cloreto de sódio 0,9% (soro fisiológico 0,9%). Após a diluição, o frasco contém 2,6ml. As doses devem ser utilizadas no intervalo máximo de 12 horas, quando devidamente armazenadas entre 2°c a 8°c. Para nova formulação importa destacar que a vacina mantém cadeia de frio apenas nas faixas de temperatura de Ultra Low Temperature (ULT), de -90°c a -60°c e de refrigeração de 2°C a 8°C. À ULT a vacina poderá ser mantida durante todo seu período de validade 6 meses, após descongelada, os profissionais deverão manter o rigor do armazenamento e transporte no intervalo máximo de validade de 10 semanas. O transporte para esta formulação poderá ocorrer durante todo o período de 10 semanas, mantendo a exigência da preservação da temperatura na faixa de refrigeração (2°C a 8°C).
PERGUNTAS FREQUENTES
| POSSO TOMAR A VACINA SE? | |
|
Já tive COVID-19 |
Sim, idealmente a vacinação deve ser adiada até a recuperação clínica total e pelo menos quatro semanas após o início dos sintomas ou quatro semanas a partir da primeira amostra de PCR positiva em pessoas assintomáticas. |
|
Estou grávida |
Sim. Tomar preferencialmente a vacina do laboratório Pfizer. |
|
Estou amamentando |
Sim. O aleitamento materno não deverá ser interrompido. |
|
Recebi outras vacinas |
Sim. As vacinas covid-19 poderão ser administradas de maneira simultânea com as demais vacinas ou em qualquer intervalo. |
|
Alergia a ovo |
Sim. |
|
Tive febre nas últimas 24 horas (>37,5º C) |
Não. |
|
Estou com febre (> 37,5º C) |
Não. |
|
Tomo corticoide |
Sim. |
|
Tomo imunossupressor |
Sim. |
|
Tomo imunobiológico (anticorpos monoclonais) |
Sim. |
|
Tomo antiagregantes plaquetários |
Sim. |
|
Tomo anticoagulantes orais |
Sim, mas por cautela a vacina deve ser administrada o mais longe possível da última dose do anticoagulante direto. |
|
Sou portador de doença reumática imunomediada (DRIM) |
Preferencialmente o paciente deve ser vacinado estando com a doença controlada ou em remissão, como também em baixo grau de imunossupressão ou sem imunossupressão. Entretanto, a decisão sobre a vacinação em pacientes com essas condições deve ser individualizada, levando em consideração a faixa etária, a doença de base, os graus de atividade e imunossupressão, além das comorbidades, recomendando-se que seja feita preferencialmente sob orientação de médico especialista. |
|
Estou em tratamento de câncer |
Recomenda-se que a avaliação de risco benefício e a decisão referente à vacinação seja realizada pelo paciente em conjunto com o médico assistente. No entanto, de maneira geral, recomenda-se que esses indivíduos sejam vacinados, salvo situações de contraindicações específicas. |
|
Sou transplantado |
Recomenda-se que a avaliação de risco benefício e a decisão referente à vacinação seja realizada pelo paciente em conjunto com o médico assistente. No entanto, de maneira geral, recomenda-se que esses indivíduos sejam vacinados, salvo situações de contraindicações específicas. |
|
Tenho imunossupressão |
Recomenda-se que a avaliação de risco benefício e a decisão referente à vacinação seja realizada pelo paciente em conjunto com o médico assistente. No entanto, de maneira geral, recomenda-se que esses indivíduos sejam vacinados, salvo situações de contraindicações específicas. |
|
Tenho alergia grave a algum dos componentes da vacina |
Não. |
|
Tive reação anafilática confirmada a uma dose anterior de uma vacina COVID-19 |
Não. |
|
Sou criança? |
Não. As crianças menores de 5 anos de idade não devem ser vacinadas. |
O VACINADOR DEVE UTILIZAR LUVAS DE PROCEDIMENTO NA APLICAÇÃO DAS VACINAS?
Não, o uso de luvas não é obrigatório na aplicação de vacinas, pois o indispensável é a higienização das mãos antes e após o procedimento. O uso de luvas só está indicado quando o vacinador estiver com lesões abertas nas mãos ou raras situações que envolvam contato com fluidos corporais do paciente. Se usadas, devem ser trocadas entre os pacientes, associadas à adequada higienização das mãos.
POSSO TOMAR A VACINA E DOAR SANGUE?
Não, fico inapto a doar sangue temporariamente, ou seja, por 48 horas para a vacina Covid-19 Sinovac/Butantan e por 7 dias para a vacina Covid-19 AstraZeneca/Fiocruz, Pfizer e Janssen.
POR QUE É IMPORTANTE TOMAR A VACINA?
Há uma série de razões, individuais e coletivas, para que todos se vacinem. Ao se vacinar, você não está protegendo apenas a si mesmo. Garantindo a própria imunidade, você protege também outras pessoas ao seu redor, evitando, assim, que a doença se propague ainda mais. Além disso, beneficiará, principalmente, aqueles que, por alguma razão, não podem se vacinar. Ou seja, quanto maior o número de pessoas vacinadas, menos vírus teremos circulando pelas ruas. Estima-se que será necessário vacinar entre 70% e 80% da população para reduzir a circulação do coronavírus e acabar com a pandemia. Sendo assim, a decisão de se vacinar tem impacto na saúde coletiva e, por isso, não pode ser encarada como uma decisão individual.
POSSO PARAR DE USAR A MÁSCARA E ÁLCOOL GEL ASSIM QUE FOR VACINADO?
Não, pois o fato de estarmos vacinados não significa que a pandemia tenha acabado. Essa situação só ocorrerá quando o número de pessoas contaminadas pelo novo coronavírus for significativamente reduzido, a ponto de diminuir a taxa de contaminação a níveis muito mais baixos do que os atuais – atingindo padrões de contaminação e gravidade similares aos da influenza, por exemplo. Só então poderemos dizer que a pandemia acabou e que é possível voltar ao seu ritmo normal de vida, sem a necessidade de uso de máscara e do isolamento.
QUANTO TEMPO A VACINA VAI DURAR? SERÁ PRECISO TOMAR TODO ANO?
Ainda não temos certeza sobre o tempo de duração da imunidade promovida pela vacina.
POR QUE A VACINA FOI DESENVOLVIDA DE FORMA TÃO RÁPIDA?
As vacinas de Covid-19 surpreenderam pela agilidade com que foram produzidas, testadas e aprovadas. Mas é importante frisar que todos os protocolos de segurança foram seguidos. Essa rapidez se deu por alguns motivos: Grande parte do tempo normalmente levado para desenvolver uma vacina era burocrático e foi flexibilizado durante a pandemia. A velocidade de desenvolvimento das vacinas é também consequência de muitos anos de evolução científica e tecnológica, que permitiram avanços na identificação da composição do vírus e a aplicação de técnicas modernas e variadas que já vinham sendo adotadas em testes de outras vacinas. Por conta da situação de pandemia, com a rápida disseminação do vírus e número expressivo de infectados, foram aceleradas as fases de teste de eficácia e segurança. Se uma parte dos voluntários adquire a doença, é possível avaliar, num período relativamente curto de tempo, a proteção oferecida pela vacina. Para realizar todas as pesquisas e testes necessários para a fabricação de uma vacina, é preciso um alto investimento financeiro. Diversos governos e instituições estão direcionando recursos para que os laboratórios desenvolvam rapidamente a vacina.
AS VACINAS CONTRA COVID-19 SÃO SEGURAS?
Sim. Para qualquer vacina ser liberada, é necessário que antes sejam feitos testes de segurança e eficácia. Sendo assim, as vacinas contra a Covid-19 estão sendo rigorosamente testadas, com milhares de voluntários em todo mundo, incluindo aqui no Brasil, tendo se mostrado seguras. As vacinas atuais são de vírus inativado ou se utilizam de parte do vírus para ativar o sistema imune. Nenhuma delas tem potencial infeccioso.
CONHEÇA OS PLANOS
- Clique aqui para baixar o PLANO NACIONAL DE OPERACIONALIZAÇÃO DA VACINAÇÃO CONTRA A COVID-19
- Clique aqui para baixar o PLANO ESTADUAL DE OPERACIONALIZAÇÃO DA VACINAÇÃO CONTRA A COVID-19
VERSÕES ANTERIORES DO PLANO ESTADUAL:
- Clique aqui para baixar o PLANO ESTADUAL DE OPERACIONALIZAÇÃO DA VACINAÇÃO CONTRA A COVID-19 (versão 07 - 30/09/2021)
- Clique aqui para baixar o PLANO ESTADUAL DE OPERACIONALIZAÇÃO DA VACINAÇÃO CONTRA A COVID-19 (versão 06 - 31/05/2021)
- Clique aqui para baixar o PLANO ESTADUAL DE OPERACIONALIZAÇÃO DA VACINAÇÃO CONTRA A COVID-19 (versão 05 - 28/04/2021)
- Clique aqui para baixar o PLANO ESTADUAL DE OPERACIONALIZAÇÃO DA VACINAÇÃO CONTRA A COVID-19 (versão 04 - 21/02/2021)
- Clique aqui para baixar o PLANO ESTADUAL DE OPERACIONALIZAÇÃO DA VACINAÇÃO CONTRA A COVID-19 (versão 03 - 14/01/2021)
VERSÕES ANTERIORES DO PLANO NACIONAL:
- Clique aqui para baixar a 11ª versão do PLANO NACIONAL DE OPERACIONALIZAÇÃO DA VACINAÇÃO CONTRA A COVID-19
- Clique aqui para baixar a 10ª versão do PLANO NACIONAL DE OPERACIONALIZAÇÃO DA VACINAÇÃO CONTRA A COVID-19
- Clique aqui para baixar a 9ª versão do PLANO NACIONAL DE OPERACIONALIZAÇÃO DA VACINAÇÃO CONTRA A COVID-19
- Clique aqui para baixar a 8ª versão do PLANO NACIONAL DE OPERACIONALIZAÇÃO DA VACINAÇÃO CONTRA A COVID-19
- Clique aqui para baixar a 7ª versão do PLANO NACIONAL DE OPERACIONALIZAÇÃO DA VACINAÇÃO CONTRA A COVID-19
- Clique aqui para baixar a 6ª versão do PLANO NACIONAL DE OPERACIONALIZAÇÃO DA VACINAÇÃO CONTRA A COVID-19
- Clique aqui para baixar a 5ª versão do PLANO NACIONAL DE OPERACIONALIZAÇÃO DA VACINAÇÃO CONTRA A COVID-19
- Clique aqui para baixar a 4ª versão do PLANO NACIONAL DE OPERACIONALIZAÇÃO DA VACINAÇÃO CONTRA A COVID-19
- Clique aqui para baixar a 3ª versão do PLANO NACIONAL DE OPERACIONALIZAÇÃO DA VACINAÇÃO CONTRA A COVID-19
- Clique aqui para baixar a 2ª versão do PLANO NACIONAL DE OPERACIONALIZAÇÃO DA VACINAÇÃO CONTRA A COVID-19
- Clique aqui para baixar a 1ª versão do PLANO NACIONAL DE OPERACIONALIZAÇÃO DA VACINAÇÃO CONTRA A COVID-19
- Clique aqui para baixar o SEGUNDO INFORME TÉCNICO - Plano Nacional de Operacionalização da Vacinação contra a Covid-19




